RACTICA 16: UN INDICADOR NATURAL.
INTEGRANTES DEL EQUIPO
PIRY HERRERA JASSO
KEVIN EDUARDO JIMENEZ ROMO
LEGNA CAROLINA LIRA AGUILA
BRISSA ARANDEY LOPEZ REYES
3cbrissalopezr19blogspot.mx
KATIA DEYANIRA LOPEZ SERNA
GUILLERMO AXEL MACIAS MACIAS
FECHA DE REALIZACION: MARTES 24 DE MAYO DE 2016
INTEGRANTES DEL EQUIPO
PIRY HERRERA JASSO
KEVIN EDUARDO JIMENEZ ROMO
LEGNA CAROLINA LIRA AGUILA
BRISSA ARANDEY LOPEZ REYES
3cbrissalopezr19blogspot.mx
KATIA DEYANIRA LOPEZ SERNA
GUILLERMO AXEL MACIAS MACIAS
FECHA DE REALIZACION: MARTES 24 DE MAYO DE 2016
1a parte:
OBJETIVO:
Obtención de un indicador natural de ácidos y bases.
HIPOTESIS
-Creímos que nosotros elaboraríamos el indicador natural
HIPOTESIS
-Creímos que nosotros elaboraríamos el indicador natural
INVESTIGACIÓN:
Escala de pH exclusiva para la col morada impresa a color.
¿Que sustancia hace que la col morada pueda usarse como indicador de pH?
¿Qué otras sustancias pueden utilizarse como indicadores de pH?

La col morada es un perfecto indicador natural, ya que puede estar fácilmente a nuestro alcance y podemos trabajar libremente con ella ya que no es toxica o no daña nuestro cuerpo, pero la col quien posee en sus hojas el indicador llamado Cianidina, es la que reacciona con otras sustancias determinando si una sustancia es ácida o alcalina dependiendo al cambio de color que se produzca.
Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Los más conocidos son el naranja de metilo, que vira en el intervalo de pH 3,1-4,4, de color rojo a naranja, y la fenolftaleína, que varía desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados/violetas. Además se pueden usar indicadores caseros como la disolución resultante de hervir con agua col lombarda (repollo colorado), pétalos de rosa roja, raíces de cúrcuma a partir de las cuales se obtiene curcumina, y otros(entre los cuales podemos destacar a la col morada y la piel de ciruela, que son usadas por algunas culturas indígenas).
FUENTES
http://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=4&cad=rja&uact=8&ved=0ahUKEwiV9OXi0__MAhUSIlIKHcWUDMwQFggvMAM&url=http%3A%2F%2Fbloquecuatroacidobase.blogspot.com%2F2011%2F11%2Fla-col-morada-es-el-indicador-ideal.html&usg=AFQjCNG0uDBPs6WiI4rSg0gNncxAwevwQw&sig2=AmqgGQsiNfeJJPf6pxGIsQ
https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&cad=rja&uact=8&ved=0ahUKEwj3k4fv2P_MAhUVb1IKHVGvCKYQFggbMAA&url=https%3A%2F%2Fes.wikipedia.org%2Fwiki%2FIndicador_de_pH&usg=AFQjCNHGSamQVf9WMTxrPIbyPDAqt5SEsQ&sig2=VbkRFih4631dYvw-t2vMcA
MATERIAL:
- Un recipiente de metal de medio litro de capacidad.
- Dispositivo de calentamiento (soporte universal, anillo de fierro, rejilla de alambre, mechero bunsen)
- Colador mediano
- Embudo de plástico.
- Botella de plástico de 1 litro vacía.
SUSTANCIAS:
- 4 hojas de col morada.
- Agua de la llave.
PROCEDIMIENTO:
- Partan las hojas de col morada en trozos pequeños.
- Pongan a calentar 400 ml de agua en el recipiente.
- Cuando el agua rompa el hervor vacíen la col morada en el recipiente. Déjenlo hervir por 5 minutos o hasta que el agua tome un color púrpura.
- Esperen a que se enfríe la mezcla y con ayuda del embudo vacíenla en la botella de plástico, tápenla y refrigeren.
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):
CONCLUSIÓN:
Nosotros no elaboramos el indicador natural pues la maestra nos comento que por falta de tiempo ella lo elaboro y nos dio en un vasito a cada equipo para poder realizar la parte dos de esta practica.También nos comento que tenia un color como azul y morado y en ese momento era como violeta o algo así.
2a parte:
OBJETIVO:
Determinar si una sustancia es ácida o básica utilizando el indicador natural de col morada.
HIPOTESIS
-Nosotros creemos que las sustancias que analizamos estarían algunas acidas y las otras bases y creímos que resultaría difícil distinguir entre ácidos y bases.
-Creímos que las sustancias presentarían cambios de color mínimos.
INVESTIGACIÓN:
¿Qué significa pH? Investiga el pH que debe tener la piel de tu cara, tu estómago, tu saliva y tu sudor y qué sucede si éste llega a alterarse.
DEFINICON DE pH
El pH, que siempre se escribe con "p" minúscula, es una escala de la cantidad de hidrógeno iónico que hay en una sustancia. La escala va de 0 a 14. El completamente pura tiene un pH de 7, que es neutro. Cuanto menor sea el número de la escala, más ácida es la sustancia. Cuanto mayor sea el número de la escala, más básica o alcalina es la sustancia. Las sustancias que son extremadamente ácidas o básicas tienden a ser corrosivas o provocar quemaduras. La escala es logarítmica, lo que significa que se basa en decenas. Así, una sustancia con un pH de 4 es 10 veces más ácida que una sustancia con un pH de 5.
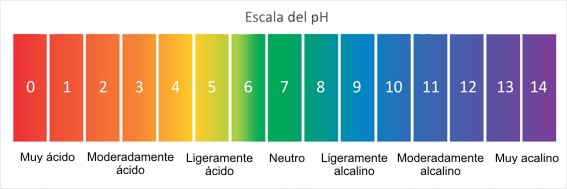
La piel tiene un pH ligeramente ácido. El pH de la piel humana varía entre 4,5 u 5,9. El ph de la piel lo produce una capa existente entre la epidermis y dermis que se llama hipodermis. La hipodermis es la encargada de lubricar la piel y protegerla de agentes invasores como las bacterias. No es lo mismo el pH de la piel de los hombres y las mujeres. En el hombre es ligeramente más ácido, 4,8 y el de las mujeres 5.
Cuando nuestro manto ácido se ve afectado, nuestra piel pierde humedad y genera tendencia a infecciones y daño. Es fundamental no dañar nuestro manto ácido porque eso acelera el envejecimiento de la piel.

pH DEL ESTOMAGO
La acidez promedia del estómago tiene un pH de 4. Cuando comemos y tomamos agua, especialmente agua alcalina, el pH del estómago sube. Cuando esto sucede el mecanismo automático del cuerpo lo detecta e inmediatamente da la orden de suministrar más ácido clorhídrico para nivelar el pH a 4. Por lo tanto el estómago vuelve a su estado ácido. Cuando tomamos más agua alcalina vuelve a suceder lo mismo.
El pH también ayuda a la digestión química de los alimentos y a la desnaturalización de las proteínas y otros nutrimentos de la dieta. Lo anterior no pasa si aumenta el pH (osea si se hace básico).
Un aumento sostenido de la acidez (como en la infección por Helicobacter Pylori) puede producir gastropatía erosiva, gastritis y ulcera péptica.
pH DE LA SALIVA
El equilibrio del pH (alcalinidad versus acidez) de la saliva normalmente varía entre 6,2 y 7,4, con niveles de pH más elevados que se observan con frecuencia durante un aumento en la secreción de la saliva, por ejemplo, al oler mientras se cocina una comida o cuando se tiene apetito y se ven fotos de alimentos.
Cuando el PH de la saliva que debería estar entre 7 a 7,4 disminuye y esa disminución se mantiene en el tiempo empezamos a ver síntomas como caries de cuello, reseción gingival, milolisis, desmineralización en el cuello, manchas blanquecinas en el esmalte .
pH DEL SUDOR
El sudor es fluido y ácido (valor del pH = 4,5) y se compone de agua, cloruro sódico, urea y ácido úrico. El sudor forma en la piel una capa protectora que puede proteger de los patógenos.
En ocasiones la sudoración excesiva y los sudores fríos pueden ser síntomas, habitualmente junto con otros como la fiebre, de alguna enfermedad como la gripe, la leucemia linfática crónica y numerosas enfermedades infecciosas.
CONCEPTO
http://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=6&cad=rja&uact=8&ved=0ahUKEwjU5bunlf3MAhVJJ1IKHbrZAV4QFghCMAU&url=http%3A%2F%2Fwww.ehowenespanol.com%2Fsignifica-ph-quimica-info_263068%2F&usg=AFQjCNFZv_NfhLNzKK-mXTkUPC4NLQyXRQ&sig2=UlvU5HN5s4hEmgcbgSm_zA&bvm=bv.123325700,d.aXo
CARA
http://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=3&cad=rja&uact=8&ved=0ahUKEwifoaKvlf3MAhVOTlIKHTxmAREQFggnMAI&url=http%3A%2F%2Fwww.teinteresa.es%2Fmicrosite%2FPregunta_al_medico%2Fpreguntas_frecuentes%2FPH-piel_0_1074493660.html&usg=AFQjCNHpXGosbLu1B_Ue0Xqz-Btg0V6etw&sig2=tYkuAswe026yfR1dRT7rYg
http://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=3&cad=rja&uact=8&ved=0ahUKEwiKza7rlv3MAhVXPVIKHaDmCQgQFggmMAI&url=http%3A%2F%2Fwww.thebeautyeffect.com%2Fbelleza%2Fph-de-la-piel-10-maneras-para-mantenerlo%2F&usg=AFQjCNFIx_LsGjAZyXeku4e__6PVmtvMXA&sig2=wzFVo3dVE4ZdGRSFe8WFIA
ESTOMAGO
https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&cad=rja&uact=8&ved=0ahUKEwjU_fOFm_3MAhVRV1IKHQ8AAQ4QFggaMAA&url=https%3A%2F%2Fmx.answers.yahoo.com%2Fquestion%2Findex%3Fqid%3D20071002080700AAOYhT5&usg=AFQjCNGrXdyZgAWYBmgSCJRbPmO_19cOQQ&sig2=2pSFRIAwlm6aKSEnuIkhPw
SALIVA
http://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&cad=rja&uact=8&ved=0ahUKEwjJ98Donf3MAhVBQFIKHRBzCBgQFgghMAE&url=http%3A%2F%2Fwww.ehowenespanol.com%2Fph-saliva-sobre_43251%2F&usg=AFQjCNEnATqw9POR-j22mcVDxTrM13pfKw&sig2=avu7aVYMfxTx4MIZOtYPtQ
http://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=6&cad=rja&uact=8&ved=0ahUKEwjJ98Donf3MAhVBQFIKHRBzCBgQFgg-MAU&url=http%3A%2F%2Fwww.clinicadentallaspalmeras.com%2FPH-saliva-clinica-dental.php&usg=AFQjCNEUf7Z9S5TP0bLw9-ROOV5K_mtAGA&sig2=ck64luZOfd3ZF2n5Hqoh2A
SUDOR
http://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&cad=rja&uact=8&ved=0ahUKEwimmru_nv3MAhVKLlIKHXpGAoYQFgghMAE&url=http%3A%2F%2Fwww.onmeda.es%2Fsintomas%2Fsudoracion.html&usg=AFQjCNHV1HyxSqMR7Z8KVWf9t5biVxCerA&sig2=tIy3es1gJJUP9NxlXOgoEg
https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=6&cad=rja&uact=8&ved=0ahUKEwjD--jQof3MAhUWGlIKHTZvBicQFgg4MAU&url=https%3A%2F%2Fes.wikipedia.org%2Fwiki%2FSudor&usg=AFQjCNEMdgSyuXSCPKGsuV9LG3Y832gIKQ&sig2=pm9USdWvuPVgSgg2Mn2UVw
MATERIAL:
- 12 cucharas desechables.
- 12 vasos desechables transparentes.
- 1 vaso de precipitado.
- Marcador permanente.
SUSTANCIAS:
- Equipo 1: Agua destilada o agua inyectable y vinagre de chiles.
- Equipo 2: bicarbonato de sodio y alka-seltzer
- Equipo 3: Jugo de frutas procesado sabor durazno y leche entera.
- Equipo 4: ´Sprite o 7 Up y bebida energética vive 100.
- Equipo 5: Pastillas de vitamina C y pinol.
- Equipo 6: Jabón líquido transparente y limones.
NOTA: Cada equipo traerá la sustancias asignadas para todos los equipos.
PROCEDIMIENTO:
- Numera los vasos del 1 al 12.
- Agrega 50 ml de agua de la llave a cada vaso.
- Vacíen una muestra de cada sustancia a examinar, una distinta en cada vaso y mezclen bien.
- Agreguen 2 cucharadas del indicador natural a cada vaso y mezclen con una cuchara limpia.
- Registren sus observaciones en la tabla siguiente:
PROCEDIIENTO EXPERIMENTAL
Con los vasos numerados vaciamos a cada uno los 50 ml de agua. después fuimos con la maestra para que nos pusiera la sustancia a examinar para hacer la mezcla y después agregar la col morada para asi poder observar los cambios.
PROTOCOLO DE SEGURIDAD
Pues simplemente teníamos que usar la bata(como siempre) y guantes,con lo que teníamos que tener cuidado es con los tubos de ensayo y mortero.
Vaso
|
Sustancia
|
color inicial
|
color final
|
pH aproximado
|
1
|
Agua destilada
| transparente | azul claro |
7
|
2
|
vinagre
| amarillento | rojo-naranja |
2
|
3
|
bicarbonato de sodio
| transparente | verde acua |
11
|
4
|
Alka-seltzer
| blanco | morado |
12
|
5
|
Jugo de frutas
| amarillo | naranja |
3
|
6
|
Leche entera
| blanco | gris |
6
|
7
|
Refresco
| transparente con burbujas | lavanda |
13
|
8
|
Bebida energética
| amarillo transparente | coral |
2-3
|
9
|
Vitamina C
| amarillo opaco | rosa |
1
|
10
|
Pinol
| blanco | verde pastel |
9
|
11
|
Jabón líquido
| semitransparente | verde esmeralda |
8
|
12
|
Jugo de limón
| verde trasparentoso | rosa mexicano |
0
|

OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):

los 12 vasos ordenados con los 50ml de agua
sustancia con agua/sustancia con indicador natural
AGUA DESTILADA
VINAGRE
BICARBONATO DE SODIO
ALKA-AELTZER
JUGO DE FRUTAS
LECHE ENTERA
REFRESCO
BEBIDA ENERGETICA
VITAMINA C
PINOL
JABON LIQUIDO
JUGO DE LIMON
LA ESCALA DE pH QUE FORMAMOS (un pequeño error el 1 va después del 6)
NUESTRAS SALIVAS
ANÁLISIS:
- De acuerdo con la escala de pH para la col morada clasifica las sustancias en ácidas y básicas.
- Ahora acomódalas de acuerdo a la escala de pH de la col morada desde el 14 hasta el 0 y haz una lista.
Jugo de limón-acido-0
Vitamina C-.acido-1
Vinagre-acido-2
Jugo de frutas-acido-3
Bebida energética-acido-2 y 3
Leche entera-acido-6
Agua destilada-neutro-7
Jabón liquido-base-8
Pinol-base-9
Bicarbonato de sodio-base-11
Observamos que todas las sustancias están divididas en 2 ramas que son ácidos y bases y estos pueden ser identificadas con distintos tipos de indicadores (en este caso el indicador natural fue la col morada),así como también comprobamos que no es difícil diferenciar estas sustancias y que con el indicador la mayoría de las sustancias analizadas presentaron un cambio extremo de color.El pH nos ayuda a poder identificar el tipo de sustancia que estamos observando (acida o básica).Vitamina C-.acido-1
Vinagre-acido-2
Jugo de frutas-acido-3
Bebida energética-acido-2 y 3
Leche entera-acido-6
Agua destilada-neutro-7
Jabón liquido-base-8
Pinol-base-9
Bicarbonato de sodio-base-11
Aka-seltzer-base-13
Refresco-base-14
Refresco-base-14
- ¿Qué aplicación práctica le encuentran a este experimento?
Que ahora nos será mas fácil identificar si un alimento es acido o básico para así controlar los alimentos que comemos y no abusar de ácidos o básicos para con todo esto mantener el pH adecuado a nuestro cuerpo, estomago, sudor, saliva y que nuestra salud se vean beneficiada.
CONCLUSIÓN:
CONCLUSIÓN:
Esta practica nos parecio muy interesante y divertida de hacer (nos emocionaban los colores).





























No hay comentarios.:
Publicar un comentario